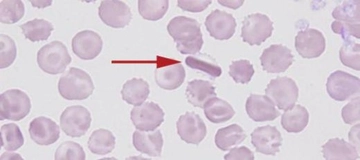
Hemoglobinin yapısında hangi bileşenler yer alır?
Hemoglobin, kırmızı kan hücrelerinde bulunan ve oksijen taşıyan bir protein olup, vücudun oksijen ihtiyacını karşılamak için hayati öneme sahiptir. Dört polipeptid zinciri ve hem gruplarından oluşan yapısı, oksijen bağlama kapasitesini ve işlevselliğini belirler.
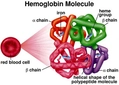
Hemoglobinin Yapısı Hemoglobin, kırmızı kan hücrelerinde bulunan ve oksijen taşıyan bir proteindir. Hemoglobin, vücudun dokularına oksijen taşımak için kritik bir rol oynar. Bu molekül, temel olarak dört polipeptid zincirinden oluşur ve her bir zincir, bir hem grubu içerir. Hemoglobinin yapısında yer alan bileşenler, bu molekülün işlevselliği açısından son derece önemlidir. 1. Polipeptid Zincirleri Hemoglobin, genellikle iki alfa (α) ve iki beta (β) zincirden oluşur. Bu yapı, hemoglobinin yapısal özelliklerini ve işlevselliğini belirler.
Bu polipeptid zincirleri, hemoglobinin üç boyutlu yapısını ve oksijen bağlama kapasitesini etkiler. 2. Hem Grupları Her hemoglobin molekülü, dört hem grubuna sahiptir. Hem grubu, demir atomunu içeren bir prostetik grup olarak işlev görür ve oksijenin bağlanmasında kritik bir rol oynar.
Bu yapılar, hemoglobinin oksijen ve karbondioksit taşıma işlevini optimize eder. 3. Oksijen Bağlama Dinamiği Hemoglobinin bir diğer önemli bileşeni, oksijen bağlama dinamikleridir. Hemoglobin, oksijenle bağlandığında konformasyonel bir değişim geçirir; bu değişim, diğer hem gruplarının oksijen bağlama afinitesini artırır. Bu durum, hemoglobinin kooperatif bir davranış sergilemesine neden olur.
Bu özellikler, hemoglobinin vücutta oksijenin taşınması ve salınımı açısından etkinliğini artırır. 4. Hemoglobinin Farklı Türleri Farklı hemoglobin türleri, organizmanın farklı gelişim aşamalarında veya farklı koşullarda bulunan değişikliklerdir.
Bu farklı türler, hemoglobinin işlevselliğini ve organizmanın oksijen taşıma kapasitesini etkileyebilir. Sonuç Hemoglobinin yapısında yer alan bileşenler, bu molekülün temel işlevselliğini belirler. Polipeptid zincirleri, hem grupları ve oksijen bağlama dinamikleri, hemoglobinin vücuttaki oksijen taşımadaki kritik rolünü destekler. Hemoglobinin farklı türleri de, organizmanın gelişimsel ve fizyolojik ihtiyaçlarını karşılamak için evrimleşmiştir. Bu nedenle, hemoglobinin yapısı ve bileşenleri, hem sağlıkta hem de hastalıkta önemli bir araştırma alanı olmuştur. |











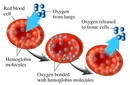












Hemoglobinin yapısı hakkında verdiğin bilgiler oldukça detaylı. Özellikle polipeptid zincirlerinin ve hem grubunun yapısı, hemoglobinin oksijen taşıma kapasitesini nasıl etkilediğine dair açıklamalar dikkatimi çekti. Oksijen bağlama dinamiklerinin kooperatif davranış sergilemesi de oldukça ilginç. Peki, bu hemoglobin türleri arasında fetal hemoglobinin, yetişkin hemoglobine göre neden daha yüksek bir oksijen affinitesi olduğunu düşünüyorsun? Bu özellik, fetusun gelişimi açısından nasıl bir avantaj sağlıyor?
Fetal Hemoglobinin Oksijen Affinitesi
Fetal hemoglobinin (HbF) yetişkin hemoglobinine (HbA) göre daha yüksek bir oksijen affinitesi olmasının temel nedeni, yapısında bulunan polipeptid zincirlerinin farklılığıdır. Fetal hemoglobin, iki alfa ve iki gamma zincirden oluşurken, yetişkin hemoglobin iki alfa ve iki beta zincirden oluşur. Bu değişim, hemoglobinin oksijen bağlama yeteneğini etkileyerek fetusun plasentadan anneden oksijen almasını kolaylaştırır.
Gelişimsel Avantajlar
Fetal hemoglobinin yüksek oksijen affinitesi, fetusun gelişimi için kritik bir avantaj sağlar. Anne karnındaki fetüs, doğrudan oksijen almadığı için plasentadan aldığı oksijeni daha etkin bir şekilde kullanmak zorundadır. HbF, düşük oksijen konsantrasyonlarında bile oksijeni daha güçlü bir şekilde bağlayarak fetüsün ihtiyaç duyduğu oksijeni temin eder. Bu durum, fetusun sağlıklı bir şekilde büyümesi ve gelişmesi için elzemdir.
Sonuç olarak, fetal hemoglobinin yüksek oksijen affinitesi, fetüsün hayatta kalmasını ve gelişimini destekleyen önemli bir adaptasyondur. Bu özellik, doğumdan önceki kritik dönemde fetüsün oksijen ihtiyacını karşılayarak sağlıklı bir gelişim süreci sağlar.